Recomendamos revisar la Fisiopatología correspondiente (Cap. 1 a 4)
INSUFICIENCIA CARDIACA
En bovinos la insuficiencia cardiaca es casi siempre una insuficiencia derecha, que se puede originar en diversas causas. Las más importantes son:
- Pericarditis traumática constrictiva
- Miocardiopatías varias, como
- Miocardiopatía genética
- Por glucogenosis tipo II
- Por deficiencia de vitamina E/Selenio
- Por intoxicación con Gossypol
- Por intoxicación con Ionóforos
- Por consumo de plantas tóxicas
- Mal de altura
- Cor pulmonale. Debemos distinguir dos situaciones diferentes
- a) Insuficiencia cardiaca secundaria a graves procesos neumónicos en animales de altura, que definimos como una de las formas de mal de altura secundario.
b) Insuficiencia cardiaca congestiva secundaria a alguna de las formas de neumonía intersticial, de acuerdo a los criterios esbozados por Radostits y col (Veterinary Medicine 10ª ed, tabla 36.1, página 1998). - Anemia
- Policitemia vera y Trombosis de la vena cava caudal.
- Leucosis enzoótica bovina
- Leucosis esporádicas
- Anafilaxis y reacciones anafilactoides
================================================================
1. Pericarditis traumática constrictiva
Es una complicación de retículoperitonitis traumática (ver cap. XI Problemas Digestivos y Hepáticos).Las vacas no discriminan contra la ingestión de cuerpos extraños (como trozos de alambre o clavos) y los tragan sin masticar.
En ocasiones un cuerpo extraño – generalmente un trozo de alambre – avanza más allá del reticulo, perforando el diafragma y el pericardio. Al interior del saco pericárdico – que por naturaleza no es elástico – se organiza un proceso séptico con fiebre moderada (40ºC) y aumento moderado de la frecuencia cardiaca, pero escasa reacción sistémica.
El saco pericárdico se llena con líquido, pus y fibrina que interfieren con la distensión del corazón, razón por la cual la sangre que llega por las venas cavas no puede ser adecuadamente evacuada hacia los pulmones y crea un éstasis sanguíneo que se manifiesta por ingurgitación de las yugulares, edema submandibular y en el pecho, así como repleción de la vena cava caudal y la vena hepática.
A la auscultación del corazón, hay cambios detectables, como tonos “alejados” (amortiguados, de baja intensidad), ruido de chapoteo y ruido de frote pericárdico.
Pericarditis traumática (Rebhun’s Diseases of Dairy Cattle)
Edema submandibular y pectoral; ingurgitación yugular
El mal de altura presenta el mismo aspecto)
Usualmente no es necesaria la confirmación con una pericardiocentesis. Si se hace, se puede comprobar la presencia de abundante líquido purulento.
El algunos casos el cuerpo extraño puede lesionar una arteria subepicárdica, hemorragia y taponamiento cardiaco que causa la muerte aguda de la vaca.
La intervención quirúrgica es factible (resección parcial de la 5ª costilla izquierda, aislar el saco pericárdico si fuese necesario para luego incidirlo, drenarlo y lavarlo con suero fisiológico con enzimas y antibióticos), pero no se justifica económicamente siendo preferible el beneficio de la vaca.
Resección parcial 5a costilla
2. Miocardiopatías
- a) Miocardiopatía genética
La miocardiopatía genética ha sido observada en animales jóvenes y en vacas adultas de las razas Holstein y Simenthal en diferentes partes del mundo.
Clínicamente se asemeja al mal de altura: corazón aumentado de tamaño, ingurgitación yugular, hígado muscado y edema submandibular y en el pecho.
Los animales afectados poseen niveles elevados de transferrina sérica así como una elevada excreción renal de la misma.
Los estudios genéticos indican que se trata de un factor autosómico recesivo ubicado en el cromosoma 18.
- b) Miocardiopatía por glucogenosis tipo II
Es una condición genética controlada por la alela recesiva de un gen autosómico.
Se caracteriza por el excesivo depósito de glucógeno en los músculos – incluso el miocardio – y en el tejido nervioso, debido a una disminución en la actividad de la enzima α-glucosidasa ácida.
Ha sido observada en un hato, algunos de cuyos terneros presentaron insuficiencia cardiaca con cardiomegalia, desde recién nacidos hasta los 16 meses de edad.
Estos terneros tuvieron EKG anormales y niveles elevados de CK y otras enzimas. Todos murieron o fueron sacrificados como consecuencia de insuficiencia cardiaca con cardiomegalia.
- c) Por deficiencia de vitamina E/selenio
Músculo Blanco “cardiaco”
El tema de distrofias musculares nutricionales será discutido con mayor detalle en otro capítulo. Aquí nos limitaremos a presentar su relación con insuficiencia cardiaca.
Hemos visto un cuadro clínico agudo fatal de insuficiencia cardíada congestiva derecha en terneros entre 3 y 6 meses de edad, que recibieron una suplementación de aceite de hígado de bacalao en la ración (como fuente de vitamina A), atribuible a la acción de ácidos grasos poli-insaturados, que actúan como factores condicionantes para deficiencias de vitamina E, de selenio, o de ambos.
Estos terneros no presentaron degeneración hialina (músculo blanco) ni en el diafragma, ni en otros músculos estriados.
Iguales efectos pueden ser causados por peróxidos y radicales libres formados es situaciones de estrés oxidativo.
Es posible que en muchos casos de insuficiencia cardiaca – no sólo en terneros, sino también en animales adultos – intervengan deficiencias de vitamina E y/o selenio, asociados a diversos factores condicionantes, como por ejemplo ejercicio exagerado.
Músculo blanco “cardiaco”
Manual Veterinario Merck
- d) Miocardiopatía por intoxicación con Gossypol
La recría menor de un año – en particular las terneras de raza Holstein, son más susceptibles.
El cuadro clínico es de insuficiencia cardiaca congestiva: ingurgitación de las yugulares, edema en el pecho, disnea y tos; anorexia y debilidad.
Un signo frecuente pero inconsistente, es hemoglobinuria.
Hemos observado que las vaquillas que lograron recuperarse de la intoxicación que sufrieron como terneras, eran más pequeñas.
Al momento del parto no presentaron insuficiencia cardiaca, pero desarrollaron un extenso edema subcutáneo irreversible desde la ubre hasta el pecho y abarcando parte de los flancos y su producción de leche fue muy escasa motivando su descarte a camal. Llamó la atención que estas vacas tenían un corazón muy pequeño y de aspecto normal.
- e) Miocardiopatía por intoxicación con Ionóforos
Ver capítulo 7 (Problemas Tóxicos)
Los ionóforos causan daño muscular, resultando en insuficiencia cardiaca congestiva y/o debilidad, ataxia y postración; frecuentemente acompañados por mioglobinuria.
- f) Miocardiopatías causasdas por plantas tóxicas
En Estados Unidos el mal de altura suele ser causado por la asociación de dos factores:
En otras partes del mundo, la ingestión de una amplia gama de plantas tóxicas puede causar lesiones al miocardio que determinan el desarrollo de insuficiencia cardiaca congestiva derecha (ver pg 421 Veterinary Medicine 10ª ed 2007 por Radostits et al).
En el Brasil (estados de Santa Catarina y Río Grande do Sul) se ha reportado diversos cuadros clínicos atribuidos a la ingestión de varias especies de plantas tóxicas.
Uno de ellos es la Doenca do Peito inchado, atribuida a la ingestión de algunas plantas tóxicas contaminando pasturas naturales. Entre ellas Tetrapterys multiglandulosa, T. acutifolia (familia Malpighiaceae) y Ateleia glazioviana (Leg. Papilionoideae).
Se afectan animales que han estado al pastoreo durante un mes o más.
Presentan disnea, edema submandibular y del pecho, ingurgitación yugular, arritmia cardiaca, líquido seroso en las cavidades, áreas pálidas en el miocardio, hígado muscado. Necrosis y fibrosis multifocal severa del miocardio. Pueden presentarse abortos.
Miocardio (ventrículo izquierdo) con dos extensos focos pálidos blanquecinos
(Colegio Brasileiro de Patologia Animal, Seropedica, RJ, Brazil)
En Africa se han observado lesiones miocárdicas similares causadas por la ingestión de otras plantas tóxicas (Pachystigma pygmaeum, P. thamnus, P. latifolium, Pavetta harborii, P. schumanniana, Fadogia monticola y F. homblei).
En Queensland, Australia, se ha reportado casos de patología múltiple en equinos y bovinos, conocida como enfermedad de St. George – en la que destaca la insuficiencia cardiaca (edema submandibular, pecho y línea media, ingurgitación yugular y diarrea, así como corazón derecho dilatado).
Ocurre el animales al pastoreo en campos contaminados con Pimelea spp (Familia Thymelaeaceae), como p.e. P. trichostachya.
3. Mal de Altura
En primer lugar, debemos reconocer que hay enfermedades (como la pericarditis traumática), cuya insuficiencia cardiaca no es condicionada por la altura. Es decir, cuyo cuadro clínico/patológico es el mismo, tanto en la altura como a nivel del mar.
En segundo lugar, debemos distinguir procesos de etiología variada, que sólo cursan con insuficiencia cardiaca en la altura, a las que nos referimos a continuación:
I. Mal de altura primario o verdadero
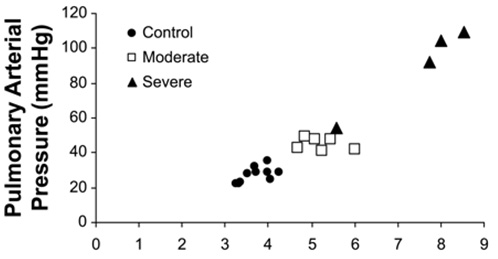
Que es la condición clínico/patológica causada por hipertensión pulmonar en respuesta a la hipoxia que ocurre a más de 2,000 m de altitud en animales no adaptados a la altura, es decir cuya introducción a la altura es más o menos reciente.
Condición que puede ser agravada por el estrés causado por la radiación solar, el frío, el desplazamiento a pasturas alejadas, y la gestación avanzada.
Su incidencia por encima de 2,000 m en ganado no criollo es de alrededor del 2 al 5%. Los terneros menores de 6 m son más susceptibles.
II. Mal de altura complicado
Es una condición clínico/patológica de insuficiencia cardiaca derecha en la altura, que es causada por la interacción de dos elementos patológicos:
- a) hipertensión pulmonar en respuesta a hipoxia de altura
- b) agentes tóxicos presentes en la altura. Tal es el caso de la presencia en Estados Unidos de algunas plantas tóxicas (Oxytropis spp, Astragalus spp), que producen el alcaloide indolizidínico conocido como swainonina. A menores altitudes este alcaloide no causa insuficiencia cardiaca, sino un cuadro tóxico neurológico.
La incidencia de esta forma de mal de altura suele ser muy elevada (hasta 100%).
III. Mal de altura secundario
Que es una condición clínico/patológica de insuficiencia cardiaca congestiva derecha que se presenta en la altura y no a nivel del mar, y que no es causado por hipertensión pulmonar primaria, sino por otros procesos patológicos (como anemia y cor pulmonale).
Hacemos hincapié en esta denominación porque hemos visto en el pasado que, tanto ganaderos como veterinarios, han descrito como mal de altura casos de bovinos que viven en la altura y que son afectados por la altura, pero que sufren de otros procesos patológicos.
En la sierra de La Libertad se dieron casos de anemia por anaplasmosis crónica que fueron diagnosticados como mal de altura.
Y en la sierra central hemos visto vacas bien adaptadas a la altura que desarrollaron un cuadro clínico idéntico al de mal de altura, pero que tenían el antecedente de haber sufrido de neumonía algún tiempo atrás. Sabemos que en el proceso de resolución de un cuadro neumónico en bovinos pueden persistir elementos fibrosos en los pulmones, que interfieren con la circulación pulmonar normal y que podrían ser responsables de un incremento en la presión arterial pulmonar y terminar causando una insuficiencia cardiaca derecha, que se puede observar en la altura pero no en la costa.
Es importante señalar que, a diferencia del hombre, en los bovinos la policitemia de altura no juega un rol en la etiopatogenia del mal de altura.
Etiopatogenia del mal de altura primario o verdadero.
No está claro para nosotros cómo opera la genética en el mal de altura.
Parece evidente que hay un condicionamiento genético para la vasoconstricción de las arteriolas pulmonares y la consiguiente hipertensión arterial pulmonar y la hipetrofia de la lámina media de las arteriolas pulmonares.
Se ha sugerido que la heredabilidad del mal de altura es de ~ 40 a > 70 %.
En los años 50 observamos en la sierra de La Libertad (Huamachuco) el cruce de toros Kyloe (West Highland) de Escocia con vacas criollas que vivían bien adaptadas a 4,000 m de altura. La F1 fue un desastre por los problemas de mal de altura que tuvieron los terneros, que eran más susceptibles que los toros Kyloe.
Esto nos sugiere la probabilidad de que los toros Kyloe tuviesen genes dominantes que pudiesen causar en sus hijas vasoconstricción de las arteriolas pulmonares y el consiguiente incremento de la presión arterial pulmonar, bajo el estímulo de la hipoxia de altura.
Tenemos también evidencia circunstancial de que el ganado Holstein americano ha ido incrementando su carga genética de susceptibilidad a la altura, tanto en el Perú cono en Ecuador. En estos países, en los años 60, las vacas Holstein estaban bien adaptadas a alturas mayores a 3,200 m, sin que se tuviesen casos de mal de altura. Pero con el boom de la inseminación artificial con semen Holstein importado de USA, fue cada vez más frecuente ver casos de mal de altura, hasta que se convirtió en un problema serio, que perdura hasta hoy.
Por otro lado, se ha sugerido que hay un factor genético autosómico dominante simple que determina una respuesta de vasoconstricción atenuada a la hipoxia, que protege hasta cierto punto a los vacunos contra el mal de altura.
Actualmente tenemos en Puno una línea Holstein bastante bien adaptada a la altura, gracias a un programa de selección llevado a cabo en San Antonio durante más de 50 años.
También tenemos vacunos criollos, descendientes de los vacunos traídos por los españoles, que están perfectamente adaptados a más de 4,000 m de altura y capaces de producir 5 a 10 litros de leche al día. Lo mismo ocurre con hatos Brown Swiss bien adaptados a alturas de 3,000 a 3,500 m.
En los años 70 se encontró en Colorado, Estados Unidos, evidencia de una susceptibilidad hereditaria a hipertensión pulmonar causada por hipoxia de altura.
También en Colorado se ha estado seleccionando toretes de razas de carne resistentes a la altura, sometiéndolos a cámaras hipobáricas por un tiempo y midiendo los cambios que sufren en la presión de sus arterias pulmonares mediante cateterismo cardiaco. Los toretes con baja presión son aptos para ser utilizados como reproductores en la altura.
Hipertrofia media arteriola pulmonar
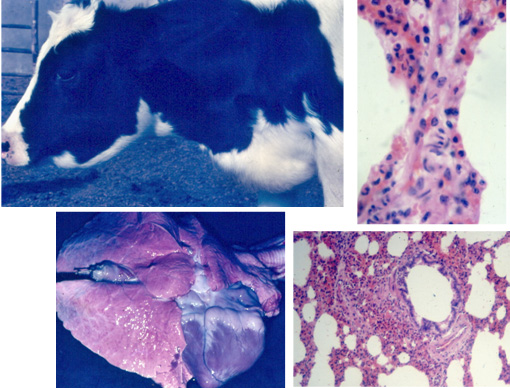
El cuadro clínico es de evolución lenta. Primero aparece la fatiga y luego se hacen patentes la ingurgitación y el pulso yugular, el edema subcutáneo submandibular y en el pecho. Se presenta disnea, cianosis, diarrea y finalmente postración.
A la necropsia se observa edema generalizado, hidropericardio, ascitis, hígado muscado, corazón derecho con hipertrofia y dilatación. En los pulmones se puede observar atelectasia, enfisema intersticial y focos neumónicos.
Los animales con mal de altura deben ser transportados a zonas más bajas, en las cuales su recuperación puede ser total.
4. Cor pulmonale
El cor pulmonale es una insuficiencia cardiaca secundaria a procesos pulmonares crónicos, como bronconeumonía, neumonía intersticial o enfisema pulmonar.
De particular importancia son los casos relacionados con neumonía intersticial.
Insuficiencia cardiaca asociada a neumonía intersticial.
La forma más común, que ha sido descrita como enfisema y edema pulmonar agudo no ha suido observada por nosotros.
Ocurre cuando animales adultos a pastoreo son movidos a pasturas nuevas y está relacionada con la ingestión de elevados niveles de D,L-triptofano contenidos en los forrajes, que es convertido en el rumen a 3-metilindol que tiene un efecto directo sobre las paredes de los broquiolos y alvéolos.
Problema observado en un establo de Lima
Algunos animales de un grupo de terneras estabuladas de 6 meses de edad comenzaron a presentar un cuadro progresivo de insuficiencia cardiaca congestiva con escasos signos de compromiso pulmonar.
Nuestra sospecha original de que podía tratarse de intoxicación por gossypol fue descartada por la ausencia de lesiones compatibles en corazón e hígado. Aunque los pulmones eran de aspecto normal, al examen histológico se observó un engrosamiento de las paredes alveolares que fue diagnosticado como neumonía intersticial.
Las observaciones clínico/patológicas permitieron descartar otras causas, como virus sincitial respiratorio, micotoxicosis por Fusarium solani, parásitos pulmonares, entre otras.
Pensamos que el problema pudo estar relacionado con una hipersensibilidad alveolar causada por la inhalación de alergenos – quizás micóticos – provenientes de un vecino silo abierto conteniendo un viejo stock de harina de semilla de algodón.
5. Anemia
Las diferentes formas de anemia en bovinos están adecuadamente explicadas en el cap. 2 de nuestra Fisiopatología Veterinaria.
En otros capítulos de este Manual nos ocuparemos de algunas importantes enfermedades que cursan con anemia como uno de sus signos cardinales. Entre ellas tenemos úlceras de abomaso, hematuria vesical enzoótica, piroplasmosis, anaplasmosis, henoglobinuria bacilar, leptospirosis y garrapatosis,
6.a Policitemia vera
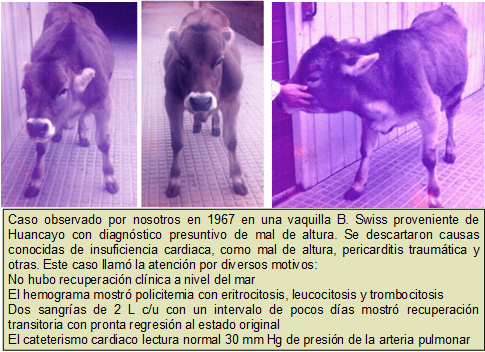
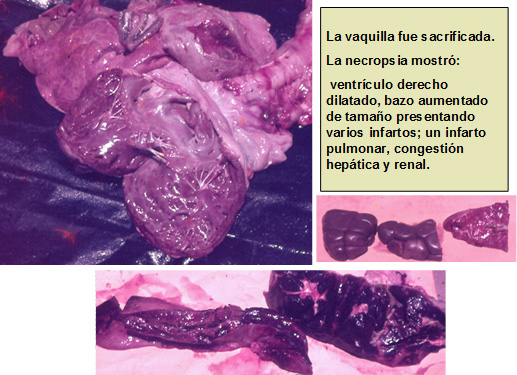
Es un raro trastorno mieloproliferativo primario de causa desconocida, del cual se han reportado unos pocos casos en bovinos a nivel mundial. Aquí presentamos un caso observado por nosotros en 1966-67.
6.b Trombosis de la Vena Cava Caudal
Esta es una forma peculiar de trombosis, común en Europa y rara en nuestro medio.
Está directamente relacionada con la formación de abscesos en el hígado como consecuencia de acidosis ruminal con ruminitis.
Eventualmente un absceso en el hígado erosiona la vena hepática y se forma un trombo que va aumentando de tamaño e ingresa a la vena cava causando éstasis venoso caudal y ascitis. De este trombo pueden desprenderse microtrombos que pasan por el corazón y llegan a los pulmones por las arterias pulmonares hasta alojarse en vasos menores ocluyéndolos. Estos vasos pueden ser erosionados causando hemoptisis, alteraciones respiratorias y epistaxis. Si la hemorragia es severa, puede causar la muerte de la vaca.
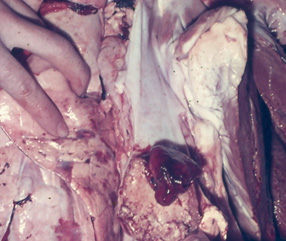
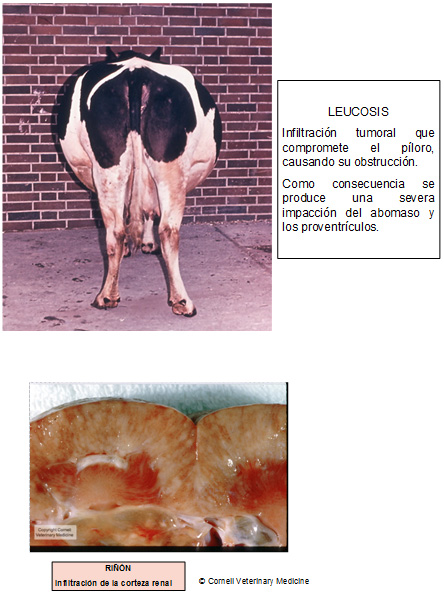
7. Leucosis enzoótica bovina
La Leucosis Enzoótica Bovina (LEB) es una infección causada por un retrovirus oncogénico que se localiza en los linfocitos.
Las formas esporádicas de leucosis bovina no están relacionadas con la LEB.
Aquí conviene aclarar algunos aspectos que pueden llevarnos a algunas confusiones:
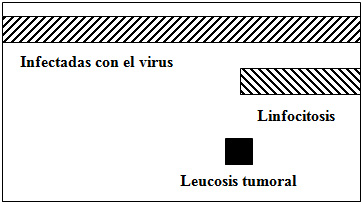
- ٠ la tasa de infección en la población adulta puede ser muy alta (30 a >70%)
- ٠ del 100% de los animales infectados, ± un 30% desarrollan linfocitosis
- ٠ igualmente, del 100% de los animales infectados, ≤5% desarrollan tumores fatales
- ٠ pero sólo un 30% de los casos tumorales también presentan linfocitosis
- ٠ un 25% de los animales infectados cursa con linfocitosis persistente, asintomática, de por vida, que constituye una proliferación benigna de linfocitos B, que no debe ser considerada como una forma subclínica de LEB sino como una manifestación distinta causada por el mismo virus.
Según Jorge Ferrer (6)
Su prevalencia en los hatos de las cuencas lecheras del Perú varía entre 30 y >70% de la población adulta y está presente en costa, sierra y selva.
De todas las cuencas lecheras, la de Arequipa tiene la prevalencia más baja (alrededor del 20%). Podría ser más baja si no se hubiese producido la introducción masiva de animales con LEB provenientes de la cuenca de Lima, debido a que SENASA no lleva a cabo el control de tránsito interno de bovinos.
Susceptibilidad
Hay factores genéticos y condiciones ambientales de estrés (como el estrés de producción lechera) que determinan que el virus ocasione algunas de las situaciones siguientes:
- 1. No infección en animales genéticamente resistentes
- 2. Infección permanente, sólo detectable por métodos serológicos (>60% de los animales infectados)
- 3. Linfocitosis persistente (<30% de los animales infectados)
- 4. Desarrollo de linfosarcomas, con o sin linfocitosis (≤5% de los infectados)
Se ha encontrado una correlación genética positiva entre alta producción y susceptibilidad a infección con el virus de la leucosis.
Pero por otro lado, las vacas infectadas que cursan con linfocitosis persistente, producen menos que lo esperado por su mérito genético, su eficiencia reproductiva es algo menor, muestran una leve depresión de su sistema inmune y son menos longevas.
Transmisión
La transmisión vertical, transplacentaria, es posible y se estima que no más del 10% de los casos de infección en terneros ocurre por esta vía.
La transmisión horizontal es la vía más común de transmisión y ocurre bajo las circunstancias más diversas, que deben ser controladas en el hato.
Se ha determinado que la dosis infectiva es de 1000 linfocitos portadores del virus, ya sea por vía oral o por vía parenteral. Enumeramos diversas formas de transmisión horizontal:
- 1. La sangre de la madre al momento del parto puede transferir dosis infectivas
2. La ingestión de calostro de vacas infectadas
3. La presencia de insectos chupadores de sangre; posible pero poco probable
4. Instrumentos no desinfectados – como los usados para descorne, tatuaje, aretado, castración o arreglo de pezuñas, nariceras. Desinfectantes recomendados (*)
5. El uso de la misma aguja para tratamientos, vacunaciones, pruebas de tbc
6. El uso del mismo guante para exámenes rectales
7. El contacto directo con animales adultos infectados es, probablemente, el factor más importante de infección. Esto queda claramente demostrado por el hecho de la recría presenta una muy baja tasa de infección, que se eleva notoriamente después del parto de las vaquillonas.
Ocurre por medio de aerosoles de las vías respiratorias y secreciones nasales, así como la saliva, la orina y los loquios de vacas paridas, todas las cuales pueden contener dosis infectivas de linfocitos.
(*) Desinfectantes recomendados
Patogenia
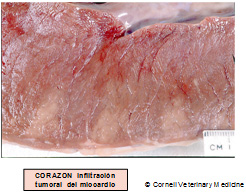
El virus de la leucosis, al interior de linfocitos infectados, cuando no ingresa por vía parenteral, ingresa al organismo por vía oral y casi siempre el primer órgano afectado es el abomaso; de allí – por vía circulatoria – llega al corazón y por vía linfática a diversos nódulos linfáticos (incluso en el espacio retrobulbar). En algunos casos alcanza el canal vertebral por vía linfática o por las raíces de nervios periféricos.
Clínica y Patología
Las fotos que presentamos a continuación dan una idea de los diferentes órganos y estructuras que pueden ser tomadas e infiltradas por el virus de la leukosis bovina y nos abstendremos de hacer descripciones clínicas y/o patológicas de esta enfermedad.
Un comentario aparte merece las leucosis esplénica por presentar un cuadro clínico/patológico sui géneris, que comentaremos más abajo.
Leucosis del bazo
Hay casos en que el virus de la leucosis alcanza el bazo directamente por vía hemática sin que que ocurra desarrollo tumoral en otros órganos. En el bazo ocurre entonces un proceso linfoproliferativo intenso, que tiene dos características peculiares:
- a) la presentación de una linfocitosis inusual, con recuentos de >30 mil linfocitos por mm3 de sangre;
- b) una marcada esplenomegalia que puede ser detectada clínicamente como un área de submacicez si se efectúa una fina percusión sobre el área del bazo (entre rumen y pulmón): examen que raras veces se lleva a cabo, de donde resulta que casi siempre ocurre la muerte súbita de la vaca por ruptura del bazo.
Control y erradicación
Nota preliminar – Es conveniente advertir que los programas de erradicación de LEB pudiesen no ser efectivos en zonas subtropicales y tropicales con alta prevalencia de vampiros, garrapatas (sobe todo Amblyoma cajenense) e insectos hematófagos (Stomoxys calcitrans, Haematobia irritans, tábanos, Ctenocephalides felis), que pudiesen actuar como vectores del virus.
También llama la atención la alta prevalencia de infección con el virus de LEB en ganado al pastoreo en zonas tropicales de Venezuela, aunque sin observarse cuadros clínicos tumorales.
Programa de erradicación
Si en un hato no existen antecedentes de LEB, lo primero que debe hacerse es verificar si el hato está infectado o no.
Siendo las vacas adultas de mayor edad las que tienen la mayor probabilidad de estar infectadas, es más conveniente y económico muestrear estos animales con el objeto de detectar la presencia en ellas de anticuerpos contra el virus de la LEB, utilizando alguna de las pruebas comerciales disponibles de ELISA.
AntelBio (Estados Unidos) ha desarrollado un ELISA para ser usado en leche. En leche de tanque puede detectar la presencia de una vaca positiva en 125. Esta prueba tiene una especificidad de 98.1% y una sensibilidad de 100%. Tiene una concordancia del 98.9% con la prueba serológica.
IDEXX (USA, Europa) tiene un ELISA para suero sanguíneo. Se puede usar en muestras individuales, o también en pool de sueros hasta de 10 animales. Tiene una especificidad de >99.4% y muy alta sensibilidad.
Si el hato resultase estar infectado con LEB, la siguiente medida consiste en elaborar un cuidadoso plan de erradicación, siguiendo lo siguientes pasos:
1) Determinar la prevalencia de animales infectados en el hato; para lo cual conviene evaluar sistemáticamente grupos más pequeños de todas las vacas del establo (incluyendo las secas), en el plazo más breve posible para evitar que los animales infectados puedan infectar a los animales libres. Este trabajo debe completarse con toda la recría.
2) Si esta evaluación por grupos sugiere una baja prevalencia, habrá que proceder a identificar a todos y cada uno de los animales positivos, dentro de los subgrupos positivos, a fin de separarlos del resto.
3) Pero si esta evaluación por grupos sugiere una alta prevalencia, será necesario que, antes de continuar con las pruebas, se haga una primera planificación para la mejor separación de animales positivos de negativos dentro del establo, teniendo en cuenta las necesidades de manejo y ordeño de los animales.
El siguiente paso consistirá en continuar con las pruebas para identificar a todos y cada uno de los animales positivos dentro de los subgrupos positivos, y proceder a separarlos de inmediato.
4) Separación de animales.
El establo debe quedar dividido de tal modo que las vacas y recría negativas no tengan contacto directo con los animales positivos.
5) Ordeño.
Las vacas negativas deben ordeñarse primero y luego las positivas.
6) Parto y suministro de calostro.
Se debe contar con maternidades individuales separadas para vacas negativas de positivas. El parto debe ser vigilado.
La ternera debe ser retirada de su madre al nacer. Bajo ningún concepto debe permitirse que mame calostro.
Ordeñar el calostro de inmediato. En el caso de vacas negativas, darle calostro a su cría dentro de una hora de nacida.
En el caso de vacas positivas, la cría no debe recibir calostro de su madre, sino calostro congelado del banco (previamente descongelado en baño maría tibio).
Una medida adicional de seguridad consiste en que antes de darles calostro a estas terneras, se les tome una muestra de sangre que se dejará coagular.
El suero obtenido se guardará en refrigeración hasta juntar varias muestras en el término de unos 4 días, que se enviarán al laboratorio solicitando una prueba de ELISA para anticuerpos de leucosis. Un resultado negativo nos indica que la ternera no fue infectada por su madre vía transplacentaria.
Las terneras con resultado negativo deben pasar a la sección de cunas de terneras negativas. Para mayor seguridad, a estas terneras se les hará una 2ª prueba a los 6 meses de edad.
Las terneras con resultado positivo deben ser eliminadas de inmediato del hato.
7) Terneros.
Los terneros machos deben estar separados y ser eliminados cuanto antes del establo.
Mantener separadas las terneras nacidas de vacas negativas de las nacidas de vacas positivas.
Crianza de terneras en cunas individuales, sin contacto directo entre ellas.
8) Alimentación: Calostro, Leche e Inicio. Destete.
El calostro verdadero es el que proviene del 1er ordeño de las vacas.
En principio, todas las terneras deberán recibir UNA sola dosis de 4 litros de calostro, dentro de la 1ª hora de nacidas. Usar sonda buco-esofágica de acero inoxidable, si fuese necesario.
Después de la cual recibirán de 2 a 3 litros de leche cada 12 horas.
Al 2º o 3er día de edad se le ofrecerá un poco de concentrado de inicio de alta calidad., que se irá incrementando día a día para garantizar su consumo ad limitum.
Alrededor de los 30 días de edad, las terneras deben estar consumiendo UN kg de concentrado de inicio. Que es el momento cuando pueden ser destetadas.
No conviene prolongar el momento del destete, porque de este modo la crianza se hace más rápida y eficiente.
No recibirán ningún forraje antes de los dos meses de edad.
9) Banco de calostro.
Los excedentes de calostro del 1er ordeño de vacas negativas pueden ser depositados en bolsas plásticas dobles de uno a dos litros y ser congelados a 20º C bajo cero, para uso futuro.
En hatos con alta prevalencia de leucosis se puede usar calostro congelado de vacas positivas para alimentar sus crías. El congelamiento destruye al virus sin afectar los anticuerpos. Por esta razón estas terneras van a ser serológicamente positivas hasta que se desvanezcan los anticuerpos calostrales, lo que va a ocurrir con seguridad a los 6 meses de edad, que es cuando se les debe hacer una 2ª prueba de ELISA.
10) Leche.
En la alimentación de las terneras se puede emplear, en orden de prioridad:
a) Leche de vacas negativas
b) Leche en polvo
c) Leche de vacas positivas, hervida en baño maría
Mediante la correcta aplicación de este programa de erradicación, la enfermedad puede desaparecer en un plazo aproximado de 5 años, cuando las últimas vacas infectadas dejen el hato.
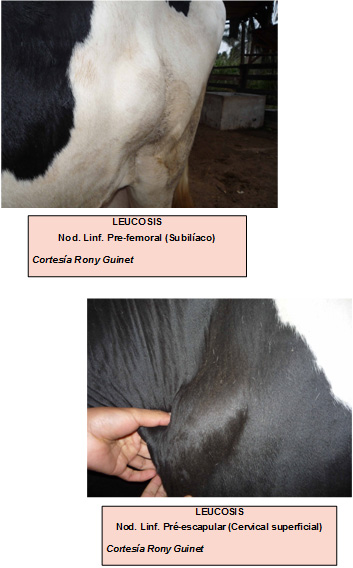
8. Leucosis esporádicas
Las leucosis esporádicas no están relacionadas con la leucosis enzoótica bovina. Las tres principales formas descritas son:
- ٠ Leucosis juvenil en terneros menores de 6 meses de edad y que presentan incremento bilateral simétrico de nódulos linfáticos.
- ٠ Leucosis tímica
- ٠ Leucosis cutánea
Se presenta en vaquillonas y vacas jóvenes. Se manifiesta por la presencia de placas nodulares de 1 a 4 cm de diámetro comprometiendo la piel y el subcutáneo sobre todo en cuello y flancos, que se acompañan de aumento de tamaño de algunos nódulos linfáticos externos, como el n. l. subiliaco.
Las placas nodulares suelen regresionar, pero usualmente reaparecen algún tiempo después, tanto en la piel como en órganos internos.
9. Anafilaxis y reacciones anafilactoides
Hemos decidido ocuparnos aquí de estos problemas y no en un capítulo aparte sobre trastornos inmunológicos.
Los conceptos aquí expuestos los hemos tomado de una publicación de los médicos Roger Jonson y Stokes Puebles: http://www.medscape.com/viewarticle/497498
Ver también: http://www.merck.com/mmhe/sec16/ch185/ch185e.html#sb185_1
Anafilaxis es una reacción sistémica de hipersensibilidad tipo I en respuesta a la ingestión o administración parenteral de diversas sustancias, que se manifiesta con una respuesta – usualmente aguda – de los sistemas cardiovascular y respiratorio, así como con alteraciones en piel y mucosas.
Las reacciones anafilactoides son idénticas a las que se observan con la anafilaxis, pero que no son mediadas por Ig E como éstas.
Los signos cardiovasculares son de hipotensión, bradicardia y síncope. Los signos respiratorios más comunes son disnea, tos yestertores pulmonares y las manifestaciones mucocutáneas frecuentes son urticaria y angioedema.
Tanto la anafilaxis como las reacciones anafilactoides resultan de la liberación sistémica de mediadores producidos por las células cebada y los basófilos, como histamina, heparina, citokinas, prostaglandinas y leucotrienos.
Una diferencia importante entre ambos problemas es que la anafilaxis siempre ocurre después que un animal haya sido previamente expuesto (sensibilizado) a un alergeno, frente al cual el sistema inmune responde con la producción de un anticuerpo IgE específico. Esto no ocurren el caso de las reacciones anafilactoides, en las cuales no hay historia de una exposición previa del animal a un alergeno.
La respuesta anafiláctica de un animal que ha sido previamente sensibilizado, ocurre por lo general después de algunos segundos; sin embargo, pueden darse respuestas retardadas que ocurren después de varios minutos y aún horas.
Reacciones a compuestos inyectables a base de vitaminas A/E + selenio
Los preparados oleosos de vitaminas A, D, E no tienen problemas. Tampoco lo tiene el selenio. Sólo ocurren con preparados hidromiscibles – con o sin selenio – y son causados por algunos solventes, excipientes o adyuvantes (como Tween 20, polisorbato 80, carboxi-metil-celulosa, y polivinil-pirrolidona o PVP). Hace algunos años se pensó que el propilenglicol también causaba estas reacciones, pero no hemos encontrado ninguna información que avale esta suposición.
Es posible que las reacciones sean de tipo anafilactoide y no de hipersensibilidad tipo I, porque no requieren de una exposición previa de sensibilización. No se sabe bien porqué el problema ocurre en unos países, regiones o establos y no en otros.
En estas reacciones, al igual que en la anafilaxis, la epinefrina (adrenalina) por vía i.m. es el tratamiento de elección. Los antihistamínicos y corticoides pueden usarse como adyuvantes, pero no sustituyen a la epinefrina.
Con respecto a la suplementación de los mencionados micronutrientes, somos de la opinión de que es mejor y más segura la suplementación oral diaria en la ración, mediante una buena premezcla de vitaminas y microelementos.
Por otro lado, debe tomarse en cuenta que la dosis inyectable de vitamina E para una vaca adulta es de 3000 UI i.m.; esta dosis no se puede alcanzar con los preparados comerciales existentes en nuestro medio (en Estados Unidos hay preparados comerciales que contienen 300 UI/mL de vitamina E, siendo la dosis de 10 mL/vaca).
El tratamiento de elección para la anafilaxis y las reacciones anafilactoides (también en medicina humana), es la administración inmediata de epinefrina (adrenalina) por vía i.m.
Los antihistamínicos y corticoides pueden usarse como adyuvantes, pero no sustituyen a la epinefrina.
Dosis de epinefrina para bovinos (Veterinary Medicine de Radostitis et al):
* solución al 1:1000 = 0.01 a 0.02 mL/kg peso vivo (= 0.01-0.02 mg/kg) vía IM o SC








25/03/2010 10:07 am
Muy interesante. Gracias.
09/05/2010 7:53 pm
Sabemos que existe una gran suceptibilidad de la leucosis enzootica bovina el ganado productor de leche y mi pregunta es las infiltraciones tumorales que se localizan en el miocardio pueden generalizarse y presentarse en ciertas zonas de la cavidad interna basicamente en abdomen y zona inguinal encapsulandose en estructuras de revestimiento, facias musculares he incluso parte de los musculos.
09/05/2010 8:07 pm
Dr. Andresen el comentario anterior obedece a que su servidor realiza examenes postmortem en animales de abasto y regularmente sacrificamos ganado vacuno productor de leche y hemos encontrado muchos casos en donde las lesiones macroscopicas que se presentan en visceras rojas y parte interna de las medias canales cerca de la zona inguinal y pubica se detecta como formaciones tumorales caracteristicas a leucosis tumoral y en algunos casos las formaciones granulomatosas similares a mycobacteriosis bovina , sabemos que tomando muestras y mandando al laboratorio para confirmar los diagnosticos seria lo mas correcto , sin embargo en la zona donde estamos se corren pruebas para TB y no para LVB. …….gracias por su atencion
10/05/2010 11:54 pm
Para JAVIER
En concreto tu pregunta es si la leucosis tumoral es factible de encapsularse.
Opino que no. Pienso que habría que buscar otras patologías que pudiesen causar las tumoraciones que observas. No se me ocurren muchas causas; TB es una, pero no creo que sea de observación frecuente.
Masas firmes de necrosis son comunes en las cavidades abdominal y pélvica. Yo las he visto en vacas gordas que han sufrido traumatización en la región pélvica al momento del parto.
Tener presente que no más del 5% de las vacas serológicamente positivas a leucosis desarrollan tumores en su vida. La vía de infección es digestiva, razón por la cual una de las principales estructuras afectadas es el abomaso. Le sigue el corazón derecho porque el virus llega alli por vía sanguínea desde el abomaso. Del corazón el virus se difunde por todas partes.
La serología para leucosis no te sirve. El examen histopatológico es tu mejor herramienta para arribar a un diagnóstico.
10/05/2010 11:59 pm
Para JAVIER
Mi comentario anterior fue incompleto.
Yo escribi:
«Masas firmes de necrosis son comunes en las cavidades abdominal y pélvica.»
Debió decir:
«Masas firmes de NECROSIS GRASA son comunes en las cavidades abdominal y pélvica.»
06/08/2010 11:58 am
Buenos dias, quisiera saber si me puede informar mas sobre la reaccion anafilactica que pueden presentar los vacunos contra el Tween 80.
Muchas gracias
Diana Acosta
16/08/2010 5:45 pm
Para DIANA
No tengo ninguna información relacionada específicamente con anafilaxis en vacunos causada por Tween 80.
En la web que transcribo se dice «A study published in December, 2005 discovered that Tween80 can cause anaphylaxis, a sometimes fatal reaction characterized by a sharp drop in blood pressure, hives, and breathing difficulties. Researchers concluded that the severe reaction was not a typical allergic response characterized by the combination of IgE antibodies and the release of histamines; it was caused by a serious disruption that had occurred within the immune system.»
http://www.whale.to/v/tween_80.html
Lee también aqui:
http://www.medscape.com/viewarticle/409498_3
Incluye la siguiente referencia:
Toman M, Krejci J, Pinka K, Mensik P. Causes of anaphylactoid reactions in cattle after administration of lipoid preparations. Vet Med (Praha) 1992;37(8):417-26.
Y aqui: http://www.ncbi.nlm.nih.gov/pubmed/1481339
http://content.karger.com/ProdukteDB/produkte.asp?Aktion=ShowFulltext&ProduktNr=224164&Ausgabe=229223&ArtikelNr=70958
19/12/2010 2:21 pm
Reciba un cordial saludo, y a la vez para hacerle la consulta siguiente:
Trabajando en un establo lechero por Cañete he tenido el gran problema de tener vacas y vaquilla paridas la presencia de sangre en calostro (60-70%), la cual persiste de 2 a 6 dias, las ubres no forman gran edema, las vacas vaquillas cumplen extrictamente su perio de transicion de 25 dias,
el tratamiento que empleo es de Vit. C (Ascorbli) y dexametasona por 3 a 5 dias, la cual da resultados, la cosa que ya no se tiene calostro para congelar.
Dr. Hans Andresen S., sia ha tenido alguna casuistica de esta y recomendacion me puede dar.
Atte.
Hector
25/01/2011 4:37 pm
Para HECTOR
La presencia de sangre en el calostro, y aún en la leche, puede ocurrir con frecuencia – especialmente en vacas de alta producción.
Es causada por la ruptura de pequeños capilares en el parénquima mamario, problema que se resuelve sólo en máximo 7 días.
No es motivo de descarte ni de alarma.
Por razones estéticas la leche con sangre no puede ir al tanque de leche para consumo humano, pero puede ser aprovechada para alimentar los terneros.
No requiere de ningún tratamiento.
17/03/2011 12:00 pm
Ante todo mil gracias por su respuesta ahora se toman las cosas con mayor calma y esta yendo muy bien, tengo una gran duda por favor si me pudiera esclareser si se justifica vacunar contra clostridiosis, es decir usar la vacuna Ultrabac 7 de Pfizer, ya que en el establo se creado la costumbre de vacunar, ahora que estoy a cargo me parece un gasto inncesario, no se que opinion o experiencia tiene Doctor acera de esta inmunizacion se recomienda o no, o a clase animales hay que vacunar.
17/03/2011 5:12 pm
Para HECTOR
Si no hay antecedentes de clostridiosis, no veo la necdesidad de vacunar.
Yo no la he usado en toda mi vida,
HANS
15/06/2011 9:21 pm
porfavor si alguien me puede explicar como es la fisiologia del edema submandibular causado por la fasiola hepatica gracias
16/06/2011 10:01 am
Para JESUS
Muy simple: se trata de un edema por hipoproteinemia causado por el daño que la Fasciola hepatica en el hígado.
10/08/2011 2:24 pm
Está muy específico éste manual del Dr. Hans Andresen. S. me gustó.
22/04/2012 1:05 pm
dr. reciba ud. un cordial saludo y a la vez agradecerle de antemano su respuesta.
mi inquietud es a que tiempo mas o menos una vaca que se a tragado un alambre o metal va a iniciar a mostrar los sintomas, teniendo en cuenta que este metal no perforo ningun organo.
Mi caso es que tuve una vaca que inicio con atonia ruminal, le di rumifar 2 dias seguidos pero esto no hizo efecto y como no defecaba tambien le di bovilaxia, bicarbonato de ca mas sus antibiotocos pero nada. entonces se decidio a sacrificar a la vaca encontrando 2 pedasos de alambre en cavidad abdominal. nuestra duda es q tiempo estuvo dentro de la vaca…gracias
15/12/2012 8:21 pm
Tengo una vaca que se trago el 50% de la cerda la cola de una yegua. Cuál sería la medida para evitar un taponamiento del Rumen ?
27/01/2013 1:10 pm
Gracias por su información tan buena. A nombre de todos sus lectores Gracias si por favor acláreme la diferencia especifica entre cor pulmonare tambien conocido como( ICC) y mal de altura no lo tengo bien claro Gracias….
11/09/2013 1:11 pm
Dr.Hans Andresen S. Antes que nada, felicidades por el articulo que aquí comenta, mi pregunta es la siguiente:Tengo una vaca con Papera inflamada y ya la he tratado con diuréticos y desinflamatorios pero el problema continua, quisiera saber cuál sería el tratamiento para este problema o de plano ya no hay. Agradecería de antemano su respuesta y saludos desde México.
25/03/2015 12:51 pm
Dr. previos saludos de antemano le agradecerè por su respuesta en terneros nacidas de vacas criollas a una altitud de 3,850 m.s.n. inseminadas con pajillas de toros importados de la raza Brown swiss es probable que le de el mal de altura? por que este caso ocurriö en la zona de Puno Peru y se realizo el tratamiento con antibioticos diureticos y vit. del complejo B como tambien con cardiotonicos, gracias por su respuesta.